Un bebé es, indudablemente, el regalo más grande y hermoso que se puede recibir.
Desde el momento de su concepción y más aún cuando lo recibes en tus manos, tu vida y mundo se ampliarán de manera indescriptible.
Padre o madre experimentan al recibirlo una gran cantidad de sentimientos encontrados: profunda e intensa alegría, admiración y/o ternura, asociados a algo de incertidumbre, sensación de sobrecarga de responsabilidades, cansancio y temor de no ser capaz de llevar la responsabilidad de ofrecerle una vida como la que esperas para ella o él.
Nadie podrá describirte estos sentimientos, hasta que los experimentes en ti mism@. La relación que se establece entre un hijo y sus padres es intensamente personal, única en cada pequeño. Es un privilegio hacer conciencia y sentir estas enormes sensaciones del espíritu.
La Academia Americana de Pediatría, en su libro “Complete and Authoritative Guide: Caring for your baby and young child birth to age 5”, nos ofrece una reflexión de cómo la llegada de un bebé a la familia es un grandioso y eterno intercambio de regalos.
Tu bebé te ofrece, entre muchas otros regalos:
- Amor incondicional e imposible de medir, lleno de admiración, afecto, lealtad y deseos de complacerte.
- Confianza absoluta; cree ciegamente en tí. Te mira y ve capaz, fuerte y sabi@.
- La emoción del descubrimiento. Aprenderás con él, descubrirás un mundo diferente al que viviste en tu niñez, alcanzarás experiencias insospechadas y capacidades que no sabías que tenías, crecerás con él y aprenderás de ti mismo, de él y del mundo que a ambos les rodea.
- Las más altas emociones. A través de tu hij@, experimentarás la alegría, el amor, la emoción y satisfacción más alta que pudieras imaginar. Claro, también llegarás a tener algo de ansiedad, enojo y frustración. Pero todas esas emociones serán parte de un tesoro que nunca querrás perder. Las emociones que los hij@s causan, varían con su crecimiento y búsqueda de independencia. Es un reto para los padres aceptarlas, recibirlas y guiar a los hij@s a su realización.
A cambio, también entre muchas otros regalos, los padres ofrecen:
- Amor incondicional. Es el amor el centro de la relación entre padres e hijos, Un alimento al corazón que debe fluir de ida y vuelta, que hace al padre sentirse pleno y al hijo seguro, capaz y sano. Un amor que requiere valor para definir claramente los límites y corregir con cariño ante sus comportamientos inapropiados o nocivos; y al mismo tiempo un amor con gran entusiasmo para propiciar su desarrollo personal seguro.
- Autoestima. Un regalo fundamental que dan los padres a los hijos es la autoestima; respeto y confianza en sí mismo; aceptación personal y en su desarrollo. Este regalo es muy sutil, se va entregando poco a poco a lo largo de los años. La sensación de que tú crees en él, logra que él crea en sí mismo. Amar a los hijos, escucharlos, pasar tiempo con ellos, alabando sus logros. Sólo si él nota que tu lo amas, admiras respetas, podrá lograr fortalecer su autoestima y crecerá feliz y emocionalmente sano.
- Valores y tradiciones: Aún cuando los padres intenten no inculcar conscientemente sus valores y tradiciones en sus hijos, ellos l@s aprenderán solos al mirar el ejemplo. Este es un gran regalo, pero requiere coherencia de tu parte. Los hijos al crecer cuestionan y se preguntarán algunos valores y tradiciones; es lo normal. Los padres que tienen estos valores y tradiciones bien razonadas, y las complen con cohencia entre lo que se dice y se hace, comúnmente tienen la capacidad de dialogar con sus hijos, sustentar sus dichos y ejemplos, y comprender los cuestionamientos naturales de un ser humano en su proceso de formación como persona sana, feliz y realizada. Nuevamente el respeto mutuo es el eje fundamental del entendimiento.
- Alegría de vivir: los hijos habitualmente son felices por sí mismos, pero requieren de sus padres las motivaciones y el soporte para dejar fluir libremente su natural tendencia a la alegría. Aunque cada pequeño tiene diferente temperamento, todos desarrollan alegría para vivir en la medida que ven a sus padres disfrutar su vida.
- Buena salud. La salud de tus hijos depende casi en su totalidad del cuidado que les des y la orientación en sus primeros años. No sólo es la nutrición y las visitas periódicas al pediatra; los hijos aprenden del ejemplo y por lo tanto tu como padre o madre debes tener buenos hábitos de vida.
- Un lugar de vida seguro, donde estén cómodos. No sólo ofrecer un espacio, cama, alimento; debe haber un ambiente de relación interpersonal seguro y saludable; donde se consigan armonía, colaboración de todos y por supuesto absoluto respeto.
- Habilidades y destrezas. Todos los niños tienen sus propias habilidades, destrezas y gustos. Está en los padres ayudarles a descubrirlas, estimular su aprendizaje y fomentar su alegría durante el proceso en que las descubren, desarrollan y perfeccionan.
La sociedad actual, se preocupa mucho por los compromisos materiales que implica la paternidad; en realidad, en este intercambio de regalos, lo más importante y lo más fructífero para el desarrollo personal de padres e hijos, se relaciona más con la aceptación y el respeto a uno mismo y a los demás; con el cariño entre todos los miembros de la familia (empezando por supuesto en el cariño entre padre y madre), ; con el tiempo que se comparte y el modo en que se comparte la vida; con una adecuada comunicación de sentimientos, pensamientos e ideas; comunicación que sea empática, con interés y asertividad.
Si ya recibiste el don de un bebé, disfruta este generoso e interminable intercambio de regalos.
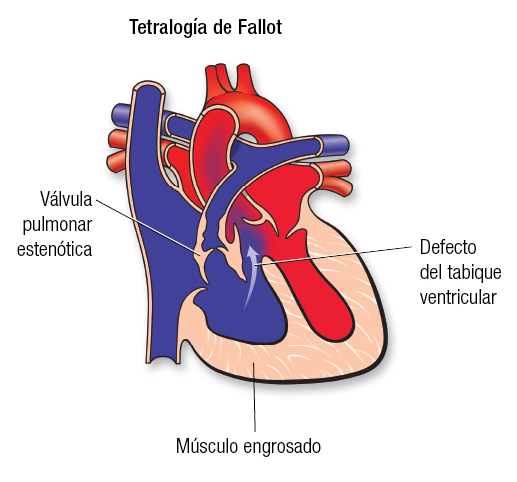
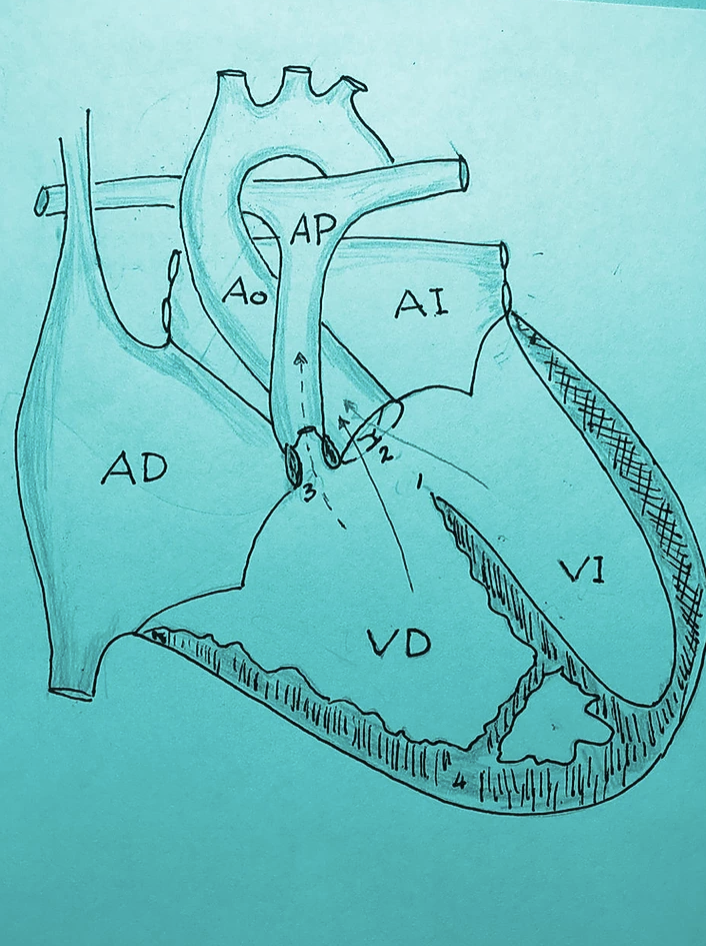
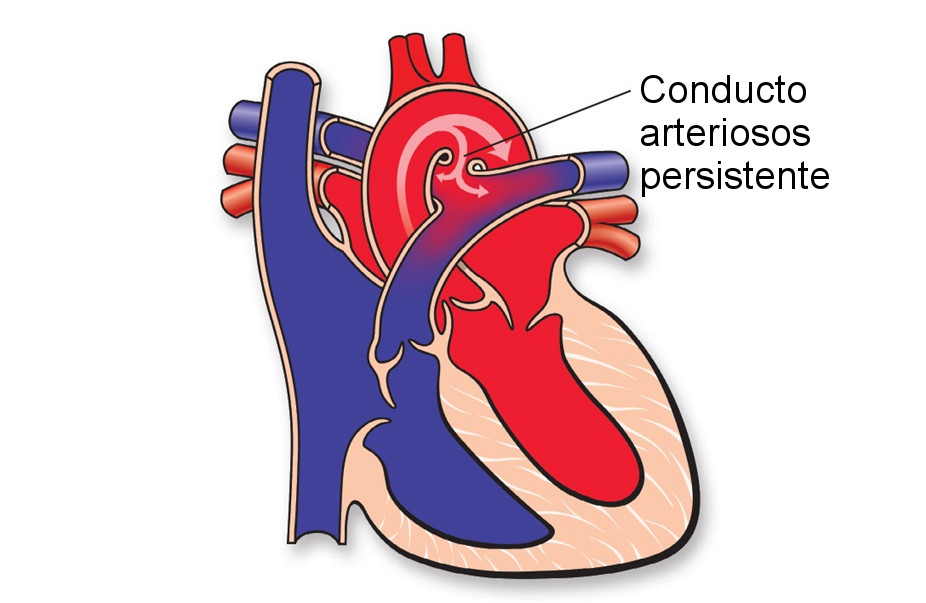
La epilepsia es una enfermedad muy antigua y actualmente es una de las principales causas de enfermedad neurológica en el mundo. En nuestro país existen cerca de 2 millones de personas se encuentran afectadas. Como dato curioso la epilepsia proviene del griego epilambanein que significa “ser presa de fuerzas del exterior”.
En nuestros días, la epilepsia se define como una alteración cerebral que puede producir o generar crisis epilépticas y su descontrol puede generar problemas clínicos, psicológicos y sociales.
¿Qué ocurre en nuestro cerebro cuando se presenta una crisis epiléptica? El cerebro normalmente se comunica mediante sinapsis neuronales, es como una corriente eléctrica. Cuando existe alguna lesión cerebral o simplemente porque la persona es portadora de algún “gen de epilepsia”, el cerebro envía señales anormales que llamamos “descargas cerebrales” que pueden extenderse a todo el cerebro (generalizadas) o solo a un área específica (parciales o focales).
¿Por qué ocurre la epilepsia? La epilepsia es una enfermedad que no respeta geografía, raza, condición social o sexo, se puede presentar en cualquier persona y a cualquier edad. De todas las personas que tienen epilepsia un 30 a 40% se debe a complicaciones del nacimiento por falta de oxigenación, enfermedades infecciosas o parasitarias como la neurocisticercosis, o por secuelas de un golpe muy fuerte en la cabeza, esto solo por poner algunos ejemplos más frecuentes. Otra causa puede ser que la persona heredó un gen que provocó la enfermedad. Pero incluso hasta un 60 a 70% no se conoce su origen.
¿Cuándo consideremos que una persona es epiléptica? Cuando se presenta al menos dos crisis que no hayan sido provocadas (por ejemplo: por un golpe, neuroinfección o problema metabólico) en más de 24 horas.
Existen varios tipos de crisis y las manifestaciones son muy variables, desde un simple cambio de comportamiento, pérdida de la consciencia, alteraciones del habla o movimientos que la persona no puede controlar. Después de la crisis las personas pueden experimentar dolor de cabeza, cansancio, debilidad y somnolencia.
¿Cómo se diagnostica la epilepsia? Lo más importante es acudir con tu médico de primer contacto quien realizará una valoración, te hará varias preguntas para identificar factores de riesgo y saber el tipo de crisis manifestada. Es probable que solicite algunos estudios para complementar el diagnóstico (electroencefalograma, exámenes de laboratorio y estudios de imagen) si el caso lo amerita, ya que cada caso es especial.
¿Cuál es el tratamiento de la epilepsia? Existen medicamentos antiepilépticos que pueden ayudar para controlar las crisis o reducir su frecuencia. La elección del medicamento depende del tipo de crisis y de las circunstancias en que se encuentra la persona afectada. Es importante que la persona que tiene epilepsia respete al pie de la letra todas las indicaciones de su médico para tener mayor control, como el no olvidar tomar la medicina, hacerlo a sus horas, llevar un calendario donde registre los eventos epilépticos, que duerma y coma bien para tratar de llevar una vida lo más saludable posible, acudir puntualmente a sus citas médicas con su doctor.
¿Qué hago en caso de que alguien de mi familia presente una crisis?
- Lo primero es mantener la calma, suena difícil, pero es la manera en que podemos pensar de manera clara y precisa que es lo que debemos hacer para ayudar.
- Acompaña todo el tiempo a la persona que esté sufriendo la crisis hasta que pase.
- Si es posible coloca a la persona en una superficie plana, coloca su cabeza sobre algo blando para que no se golpee contra el suelo, una chamarra doblada podría ayudar.
- Quita objetos que puedan lastimarle cerca de el/ella y aléjalo de cualquier peligro (agua, escaleras).
- Ponle de lado para que pueda respirar mejor y limpia su saliva o restos de comida de su boca.
- Evita introducir objetos a la boca (dedos, abatelenguas, cuchar), ni trates de abrirla, puedes lastimarle o lastimarte tu.
- Desabrocha o afloja su ropa en la parte del cuello.
- Evita detener los movimientos, sujetándolo con fuerza o inmovilizándole, a menos que corra peligro inmediato.
- Evite darle medicamentos o comida, espere a que se encuentre completamente despierto y consciente.
- Cuando termine la crisis ayúdele a orientarse y tome nota de la crisis en su calendario para mantener un registro de cada una de las crisis.
- Si la crisis no cede en 5 minutos, llame a la ambulancia o llévelo a urgencias del hospital más cercano.
Referencias Bibliográficas:
Shelov, Steven P. editor-in.chief….[et al.], Caring for your baby and young Child. Birth to age 5. American Academy of Pediatrics. BANTAM BOOKS, USA. 2009. ISBN 978-0-533-38630-1